Liens rapide
Ablation tumorale
Une solution minimalement invasive de traitement du cancer
Qu’est-ce qu’une ablation tumorale?
Il s’agit d’une intervention minimalement invasive utilisée dans le traitement des tumeurs solides. On applique de l’énergie thermique ou des produits chimiques directement sur la tumeur afin de la détruire totalement ou en grande partie1. L’imagerie radiologique permet de guider et de positionner une aiguille spéciale dans la tumeur. Il s’agit d’une intervention percutanée, ce qui signifie qu’elle ne nécessite qu’une toute petite incision, habituellement de moins de 3 mm, par laquelle l’aiguille est insérée.
Son efficacité est maximale dans les types de cancers suivants:
- Cancer du foie
- Cancer du rein
- Cancer du poumon
- Cancer des os
- Ainsi que les cancers qui ont métastasé dans ces régions.
Intervention chirurgicale ou ablation?
Les patients dont l’état ne leur permet pas de subir une intervention chirurgicale peuvent bénéficier d’une ablation tumorale : cette intervention comporte moins de risques et peut avoir une action soit palliative, soit curative sur leurs symptômes. Par ailleurs, les tumeurs de petite taille peuvent être traitées efficacement par ablation tumorale, ce qui évite d’avoir à recourir à une intervention chirurgicale beaucoup plus invasive.
Techniques courantes
Il existe un grand nombre de méthodes d’ablation tumorale, que cette dernière soit réalisée de façon thermique ou chimique. Voici les plus courantes:
- Ablation par radiofréquence: diffusion de courants électriques à haute fréquence par une électrode située dans l’aiguille, ce qui crée une petite zone de chaleur afin de tuer la tumeur.
- Ablation par micro-ondes: diffusion de micro-ondes par l’aiguille pour créer une petite zone de chaleur afin de tuer la tumeur de façon thermique
- Cryoablation: utilisation d’azote liquide ou d’argon afin de créer un froid intense qui gèle la tumeur et la tue
- Ablation chimique: injection de produits chimiques comme l’éthanol ou l’acide acétique directement dans la tumeur
Accès aux soins
Selon une étude de 2014 menée dans les hôpitaux de l’Ontario, moins de 45 % des hôpitaux offrent l’ablation tumorale; cependant, 75 % des hôpitaux seraient prêts à offrir ces services si on leur fournissait le financement approprié. Les hôpitaux qui offrent des interventions d’ablation sont concentrés dans la région de Toronto et dans le sud-ouest de l’Ontario.
Avantages
- Traitement du cancer chez les patients qui ne peuvent pas subir d’intervention chirurgicale
- Fort taux de réussite
- Rétablissement rapide
- Résultats prouvés
Affiche
Liste des installations
Remarque : les renseignements contenus sur la présente page sont offerts uniquement à titre d’information et ne doivent pas se substituer aux conseils, au diagnostic ou aux traitements médicaux d’un professionnel de la santé. La liste fournie ici ne contient que les membres de l’Association canadienne pour la radiologie d’intervention (CAIR) qui ont signalé qu’ils effectuent l’intervention indiquée. Il est important de savoir qu’il ne s’agit pas d’une liste exhaustive de tous les médecins ou tous les établissements en mesure d’effectuer l’intervention. Les médecins dont les noms et établissements figurent dans la liste sont des membres de CAIR qui ont fourni leurs coordonnées volontairement. Nous nous efforçons de tenir ces renseignements à jour, mais CAIR ne garantit pas l’exactitude, l’exhaustivité, ni le caractère actuel des renseignements fournis. La présence d’un nom dans cette liste n’implique aucunement le soutien de CAIR ni une recommandation des services de cette personne.
Les patients sont encouragés à effectuer leurs propres recherches et à consulter un fournisseur de soins de santé qualifié afin de prendre des décisions éclairées quant aux soins qu’ils doivent recevoir. CAIR n’assume aucune responsabilité quant aux actions fondées sur les renseignements fournis sur la présente page ni quant à d’éventuelles erreurs ou omissions dans son contenu. L’utilisation de ces renseignements se fait à vos propres risques.
Pour toute demande ou vérification des compétences professionnelles et des qualifications d’un fournisseur de soins de santé, veuillez communiquer avec le comité ou l’autorité d’accréditation de votre région.
ALBERTA
Calgary
Foothills Hospital
1403 29th St NW
Calgary, Alberta T2N2T9
Canada
Dr. Stefan Przybojewski
Dr. Jason Wong
Phone: 403-944-4634
Fax: 403-944-1687
Email: stefan.przybojewski@albertahealthservices.ca
Email: wongjk@ucalgary.ca
Type de procédures ablatives:
- Foie
- Poumon
- Os
- Tissu mou
Edmonton
University Hospital – Diagnostic Imaging
8440-112 St NW
Edmonton, Alberta T6G2B7
Canada
Dr. Philippe Sarlieve
Phone: 780-407-7881
Email: philippe.sarlieve@albertahealthservices.ca
Type de procédures ablatives:
- Foie
- Rein
COLOMBIE-BRITANNIQUE
Kelowna
Kelowna General Hospital
2268 Pandosy
Kelowna, British Columbia V1Y1T2
Dr. Nevin de Korompay
Phone: 250-862-4454
Fax: 250-862-4357
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
New Westminster
Royal Columbian Hospital
330 E Columbia St.
New Westminster, British Columbia V3L3W7
Canada
Dr. Zameer Hirji
Phone: 604-520-4640
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Vancouver
Vancouver General Hospital
899 W 15th Avenue
Vancouver, British Columbia V5Z 1M9
Canada
Dr. Anastasia Hadjivassiliou
Phone: 604-875-4111 ext 68612
Email: anastasia.hadjivassiliou@vch.ca
Type de procédures ablatives:
- Foie
- Rein
Victoria
Vancouver Island Health Authority
1 Hospital Way
Victoria, British Columbia V8Z6R5
Canada
Dr. Vamshi Kotha
Phone: 250-370-8000 ext. 14208
Email: vamshikotha@gmail.com
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Victoria General Hospital
1 Hospital Way
Victoria, British Columbia V8Z6R5
Canada
Dr. Paul Sobkin
Phone: 250- 727-4208
Email: paul.sobkin@islandhealth.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
MANITOBA
Winnipeg
Health Sciences Center Winnipeg
820 Sherbrook Street
Winnipeg, Manitoba R3A 1R9
Canada
Dr. Alessandra Cassano-Bailey
Tel: 204-787-7620
Type de procédures ablatives:
- Foie
St Boniface General Hospital
409 Tache Ave
Winnipeg, Manitoba R2H2A6
Dr. Suri Dhaliwal
Type de procédures ablatives:
- Rein
Dr. Sookhoo Siuchan
Tel: 204-237-2526
Fax: 204-237-7439
Email: ssookhoo@sbgh.mb.ca
Type de procédures ablatives:
- Foie
- Rein
- Tissu mou
NOUVEAU BRUNSWICK
Moncton
Dr. Georges-L.-Dumont University Hospital Centre
330 Université Ave.
Moncton, New Brunswick E1C 2Z3
Canada
Dr. Jordan Court
Tel: 506-862-4000
Email: Jordan.Court@vitalitenb.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
NOUVELLE-ÉCOSSE
Cape Breton
Cape Breton Regional Hospital
118 Crescent Street, Sydney, Nova Scotia B1S 2Z8
Canada
Dr. Navid Tofighirad
Tel: 437-988-2171
Type de procédures ablatives:
- Rein
Halifax
QEII Health Sciences Centre
VGH, Victoria Building – 3rd floor North Wing, Dept of Radiology, 1276 South Park Street
Halifax, Nova Scotia B3H 4B2
Canada
Dr. Mike Rivers-Bowerman
Phone: 902-473-5477
Fax: 902-425-6199
Email: michael.rivers-bowerman@nshealth.ca
Website: https://medicine.dal.ca/departments/department-sites/radiology/contact/faculty/mike-rivers-bowerman.html
Type de procédures ablatives:
- Foie
- Rein
ONTARIO
Barrie
Royal Victoria Regional Health Centre
201 Georgian Drive
Barrie, Ontario L4M6M2
Canada
Dr. Arshdeep Sidhu
Phone: 905-728-9802
Email: asidhu@wedi.ca
Website: https://georgianvit.com
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Hamilton
Juravinski Cancer Centre
699 Concession Street
Hamilton, Ontario L8V 5C2
Dr. Sriharsha Atheya
Phone: 905-521-2100
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
St Joseph Healthcare Hamilton
50 Charlton Ave E
Hamilton, Ontario L8N 4A6
Canada
Dr. Oleg Mironov
Phone: 905-522-1155 ext. 35387
Fax: 905-540-6576
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Kingston
Kingston Health Sciences Centre
76 Stuart St
Kingston, Ontario K7L2V7
Dr. Ben Mussari
Phone: 613-548-2301
Email: ben.mussari@kingstonhsc.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
Dr. Alexandre Menard
Phone: 613-549-6666, ext 4902
Email: Alexandre.Menard@kingstonhsc.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
London
London Health Sciences Centre
C2-200 Victoria Hospital-LHSC 800 Commissioners Road East
London, Ontario N6A 5W9
Dr. Amol Mujoomdar
Phone: 519-685-8500 ext 54965
Fax: 519-667-6872
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Western University
LHSC-VH, 800 Commissioners Rd E
London, Ontario N6A5W9
Dr. Derek Cool
Phone: 519-685-8500 ext 54965
Fax: 519-667-6872
Type de procédures ablatives:
- Foie
- Rein
Oshawa
Lakeridge Health
1 Hospital Ct.
Oshawa, Ontario L1G 2B9
Dr. Sean Galante
Phone: 905- 576-8711 ext 33527
Type de procédures ablatives:
- Foie
- Rein
- Os
- Tissu mou
Peterborough
Peterborough Regional Health Centre
1 Hospital Dr
Peterborough, Ontario K9J 7C6
Canada
Dr. Sohail Zaheer
Type de procédures ablatives:
- Foie
- Rein
Dr. Fady Abdelsayed
Type de procédures ablatives:
- Foie
- Rein
Dr. Nazmus Sakib
Phone: 705-743-2121, ext 5020
Type de procédures ablatives:
- Foie
- Rein
Dr. Kebby King
Phone: 705-743-2121, ext 5020
Type de procédures ablatives:
- Foie
- Rein
Scarborough
Scarborough Health Network
3050 Lawrence avenue east
Scarborough, Ontario M1P 2V5
Canada
Dr. Zain Badar
Phone: 416-431-8167
Email: Zbadar@shn.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
St. Catherine
Niagara Health
1200 Fourth Ave
St. Catharines, Ontario L2S0A9
Canada
Dr. Mahmood Albahhar
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Toronto
Humber River Hospital
1235 Wilson Ave
Toronto, Ontario M3M0B2
Canada
Dr. Edwin Zhang
Phone: 416-242-1000 ext 63311
Fax: 416-242-1078
Email: Edzhang@hrh.ca
Type de procédures ablatives:
- Foie
- Rein
- Os
Toronto General Hospital and Mount Sinai Hospital
585 University Avenue, 1-PMB-294
Toronto, Ontario M5G 2N2
Dr. John Kachura
Phone: 416-340-4800 ext. 6779
Fax: 416-593-0502
Email: john.kachura@uhn.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Trillium Health Partners
2200 Eglinton Ave W
Mississauga, Ontario L5M 2N1
Canada
Dr. Tara Graham
Phone: 905-813-1100 ext 6255
Fax: 905-813-3956
Email: tara.graham@thp.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
Vaughan
Cortellucci Vaughan Hospital
3200 Major MacKenzie Dr W
Vaughan, Ontario L6A 4Z3
Canada
Dr. Peter De Maio
Phone:905-417-2000 ext 2004
Fax: 905-883-0772
Type de procédures ablatives:
- Rein
Windsor
Windsor Regional Hospital
1030 Ouellette Ave
Windsor, Ontario N9A 1E1
Canada
Dr. Jamil Addas
Phone: 519-254-5577
Fax: 519-258-9688
Email: Jamil.addas@wrh.on.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Dr. Matthew Rochon
Phone: 519-254-5577 ext 31330
Email: matthewrochon@gmail.com
Type de procédures ablatives:
- Foie
- Poumon
- Rein
QUEBEC
Montreal
CHUM
1090 rue de Bleury
Montreal, Quebec H2Z0B7
Canada
Dr. Ricardo Holderbaum do Amaral
Phone: 514-659-8000
Email: ricardo.amaral.med@ssss.gouv.qc.ca
Type de procédures ablatives:
- Foie
- Rein
- Os
- Tissu mou
CHUM
1000 St-Denis
Montreal, Quebec H2X 0C1
Canada
Dr. Jean-Sebastien Billiard
Phone: 514-890-8000
Email: js.billiard@umontreal.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Hôpital Sacré Coeur de Montréal
5400 Boul Gouin O
Montreal, Quebec H4J 1C5
Canada
Dr. Ahmed Bentridi
Phone: 514-338-2222 ext 2844
Email: ahmedbentridi@yahoo.fr
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Tissu mou
McGill University Health Centre
1001 Bd Decarie
Montreal, Quebec H4A 3J1
Canada
Dr. Louis-Martin Boucher
Phone: 514-934-1934 ext. 44454
Fax: 514-843-2893
Email: louis-martin.boucher@mcgill.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Sherbrooke
Centre Hospitalier Universitaire de Sherbrooke
3001, 12e av Nord
Sherbrooke, Quebec J1H5H3
Canada
Dr Maxime Noël-Lamy
Phone: 819-346-1110, ext 14964
Fax: 819-829-3296
Email: Maxime.noel-lamy@usherbrooke.ca
Type de procédures ablatives:
- Foie
- Poumon
- Rein
- Os
- Tissu mou
Quebec
CHU de Québec – Hôpital Enfant Jésus
1401 18e Rue
Québec, Quebec G1J 1Z4
Canada
Dr. Jean-Nicolas Racicot
Phone: 418-525-4444, ext 63680
Email: jean-nicolas.racicot.med@ssss.gouv.qc.ca
Type de procédures ablatives:
- Foie
- Rein
- Os
- Tissu mou
Trois-Rivieres
CIUSSS MCQ – CHAUR
1991 Boul de Carmel
Trois-Rivieres, Québec G8Z 3R9
Canada
Dr. Mathieu Malenfant
Phone: 819-697-3333
Type de procédures ablatives:
- Poumon
- Rein
SASKATCHEWAN
Royal University Hospital
103 Hospital Drive
Saskatoon, Saskatchewan S4N0W8
Canada
Dr. Robert Otani
Phone: 306-655-2371
Fax: 306-655-6304
Email: robert.otani@saskhealthauthority.ca
Type de procédures ablatives:
- Foie
- Os
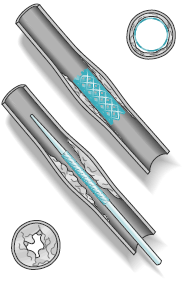 Dans certains cas, on utilise les endoprothèses pour traiter les patients souffrant de maladie hépatique grave. Ces patients connaissent souvent des hémorragies engageant le pronostic vital, car le foie est trop abîmé pour supporter le flux sanguin normal. Une technique appelée TIPS, qui utilise une endoprothèse pour connecter deux veines et diverger le sang du foie, constitue un des moyens de traiter cette maladie.
Dans certains cas, on utilise les endoprothèses pour traiter les patients souffrant de maladie hépatique grave. Ces patients connaissent souvent des hémorragies engageant le pronostic vital, car le foie est trop abîmé pour supporter le flux sanguin normal. Une technique appelée TIPS, qui utilise une endoprothèse pour connecter deux veines et diverger le sang du foie, constitue un des moyens de traiter cette maladie. La maladie artérielle périphérique, ou MAP, est un trouble dans lequel les artères qui alimentent les bras ou les jambes se rétrécissent ou s’obturent, ce qui interfère avec la circulation normale du sang. La MAP est le plus souvent la conséquence d’une athérosclérose (durcissement des artères). L’athérosclérose correspond à une accumulation progressive de cholestérol et de tissu cicatriciel, formant ce qu’on appelle une « plaque » qui bouche les vaisseaux sanguins. La MAP peut également être provoquée par des caillots sanguins.
La maladie artérielle périphérique, ou MAP, est un trouble dans lequel les artères qui alimentent les bras ou les jambes se rétrécissent ou s’obturent, ce qui interfère avec la circulation normale du sang. La MAP est le plus souvent la conséquence d’une athérosclérose (durcissement des artères). L’athérosclérose correspond à une accumulation progressive de cholestérol et de tissu cicatriciel, formant ce qu’on appelle une « plaque » qui bouche les vaisseaux sanguins. La MAP peut également être provoquée par des caillots sanguins.
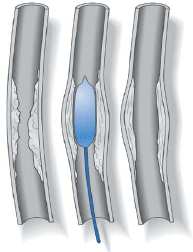 Les médecins disposent d’un certain nombre de méthodes pour ouvrir les vaisseaux sanguins au niveau des blocages et pour rétablir une circulation sanguin normale. Dans de nombreux cas, on peut pratiquer ces interventions sans chirurgie, en utilisant des techniques modernes de radiologie d’intervention. Les radiologistes d’intervention sont des médecins qui pratiquent ces interventions en utilisant de très petits tubes, ou cathéters, ainsi que d’autres outils miniaturisés et des rayons X.
Les médecins disposent d’un certain nombre de méthodes pour ouvrir les vaisseaux sanguins au niveau des blocages et pour rétablir une circulation sanguin normale. Dans de nombreux cas, on peut pratiquer ces interventions sans chirurgie, en utilisant des techniques modernes de radiologie d’intervention. Les radiologistes d’intervention sont des médecins qui pratiquent ces interventions en utilisant de très petits tubes, ou cathéters, ainsi que d’autres outils miniaturisés et des rayons X.